V této kapitole si představíme, zatím bez podrobnějšího zkoumání, některé základní poznatky, na kterých celá fyzika stojí. Budou se nám hodit v dalším studiu, proto na chvíli přeskočíme staletí fyzikálních objevů. Začneme strukturou hmoty. Asi nejdůležitějším objevem fyziky je fakt, že všechno kolem nás se skládá z atomů. „Atomos” znamená v řečtině nedělitelný, což nás odkazuje na nejmenší možnou, dále nedělitelnou částici hmoty.
Dnes už víme, že atom ve skutečnosti není tzv. elementární částicí, má svoji strukturu a dělit se dá. Atomy se skládají z jádra a obalu. V jádru najdeme protony a neutrony a obal je tvořen elektrony (viz obrázek).

Zdroj
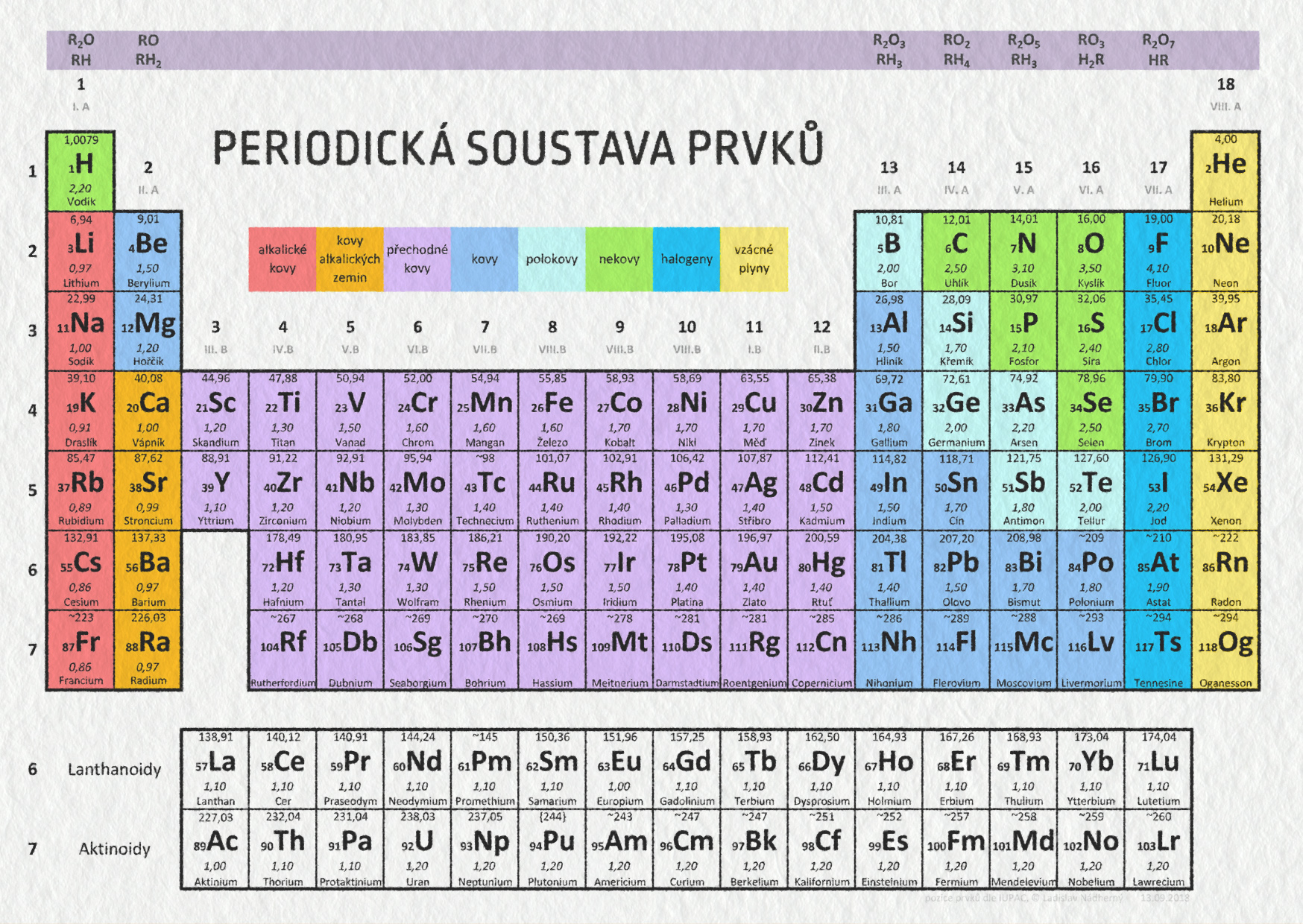
Přestože atomy mají strukturu, stále je můžeme považovat za základní stavební kameny běžné hmoty, neboť rozbíjení atomu neprobíhá v přírodě příliš často. Počtem protonů v jádře je určeno, o jaký chemický prvek se jedná. Názvy a složení prvků najdeme v periodické tabulce (viz obrázek). Dnes už víme, že stabilních prvků je v přírodě 92. Z těchto 92 druhů atomů je tedy vytvořen ten úžasně rozmanitý svět kolem nás.
Na závěr je potřeba připomenout, že rozměry atomu jsou opravdu velmi malé – cca 0,000 000 000 1 m. Lepší představu nám o tom dá následující příklad.
Zdroj
Nejdřív si spočítáme zvětšovací poměr: pomeranč má 10 cm = 0,1 m. Takže zvětšovací poměr je 0,1 m / 0,000 000 000 1 m = 1 000 000 000. Pokud člověka o výšce přibližně 2 m zvětšíme ve stejném poměru, dostaneme 2 m · 1 000 000 000 = 2 000 000 000 m = 2 000 000 km. To je asi pětinásobek vzálenosti Země–Měsíc.
Protony a elektrony jsou nabité a mohou na sebe působit elektrickou silou. Elektrická síla způsobuje, že některé atomy se mohou spojovat do větších celků, kterým říkáme molekuly. Pravidla spojování atomů jsou předmětem zájmu chemie.
Atomy se nikdy nezastaví, jsou v neustálém pohybu a s rostoucí teplotou roste jejich průměrná rychlost. Zároveň se může s rostoucí teplotou měnit i jejich uspořádání – skupenství:
- Pevné skupenství: Atomy jsou těsně u sebe, svázány vzájemně pevnými vazbami. Většinou tvoří také pravidelnou strukturu – krystal.
- Kapalné skupenství: Atomy (molekuly) jsou těsně u sebe, ale žádné pevné vazby se díky vyšší teplotě nevytvoří. Pokud atomy drží pohromadě, tak jen velmi slabými vazbami.
- Plynné skupenství: Atomy (molekuly) se volně pohybují prostorem, naráží do sebe nebo do stěn nádoby. Je mezi nimi hodně volného místa.
- Plazma: Někdy je považováno za čtvrté skupenství látek. Teplota je tak velká, že se začnou oddělovat z atomů elektrony a vznikají ionty.
Na stole je hrnek s horkou kávou. Vy sedíte u stolu a cítíte její vůni. Popište situaci z pohledu atomů a molekul.
Molekuly vody, ale i další látky v kávě obsažené se vypařují a uvolňují do vzduchu. Vzduch v místnosti není zcela v klidu a jeho proudění donese molekuly až do našeho nosu. Čichové buňky ve vašem nose rozpoznají známou vůni a pošlou do mozku informaci o vonící kávě.

