Avogadrova konstanta
Úkol: Experimentálně určete hodnotu Avogadrovy konstanty

Zdroj
Vybavení: Nádobka obdélníkové podstavy k provádění elektrolýzy, dvě měděné elektrody, zdroj napětí 24 V, reostat, ampérmetr, analytické váhy (citlivost minimálně 0,01 g), stopky, vodiče, smirkový papír, fén, vodný roztok modré skalice CuSO4
Avogadrova konstanta \(N_\mathrm{A}\) udává počet částic v jednom molu. Její hodnota nebyla zvolena náhodně, ale vychází z experimentu. Přesněji řečeno, hodnotu Avogadrovy konstanty je možné určit pomocí nějaké jiné fyzikální konstanty. V našem případě pomocí elementárního náboje \(e=1{,}602\cdot10^{-19}\ \mathrm{C}\).
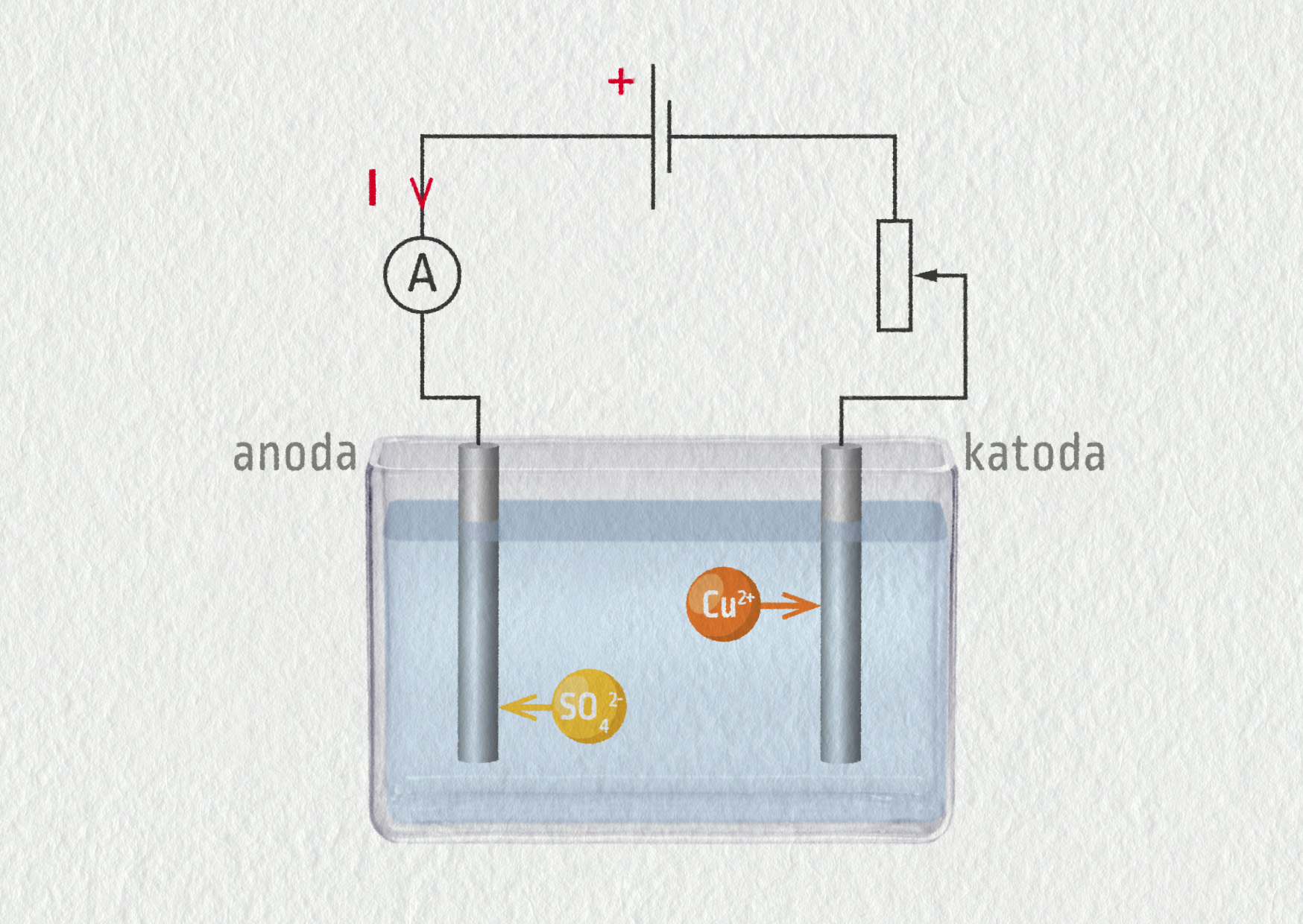
K měření této důležité konstanty použijeme elektrolýzu – fyzikálně-chemický děj, při němž se přenáší látka pomocí elektrického proudu. Roztok modré skalice obsahuje ionty měďnaté \(\mathrm{Cu}^{2+}\) a ionty síranové \(\mathrm{SO}_4^{2-}\). Po vložení elektrod do roztoku a připojení zdroje napětí budou kladné ionty \(\mathrm{Cu}^{2+}\) přitahovány zápornou katodou, kde se budou redukovat a ulpívat v podobě neutrálního kovu. Hmotnost katody se zvětšuje. Ionty \(\mathrm{SO}_4^{2-}\) jsou přitahovány kladnou anodou, reagují s jejím povrchem. Atomy mědi tvořící anodu jsou oxidovány a vstupují do roztoku, hmotnost anody klesá. Svým pohybem ionty \(\mathrm{Cu}^{2+}\) přenášejí v kapalině elektrický náboj. Na základě měření elektrického proudu, času a přírůstku hmotnosti katody lze vypočítat, kolik iontů mědi se na ní vyloučilo.
Postup měření:
- 1) Smirkovým papírem očistěte povrch elektrod, který bude ponořen v roztoku.
- 2) Vážením určete počáteční hmotnost katody \(m_\mathrm{K1}\) s přesností na 0,01 g.
- 3) Sestavte obvod podle schématu. Po připojení ke zdroji ihned pomocí reostatu nastavte proud 1,2 A a spusťte časomíru.
Zdroj
- 4) Elektrolýzu nechte probíhat 30 minut. Průběžně kontrolujte velikost proudu, případně ji upravte pomocí reostatu. Mezitím na internetu vyhledejte nebo s učitelem prodiskutujte chemické děje na elektrodách a odvoďte vztah pro výpočet \(N_\mathrm{A}\).
- 5) Po skončení elektrolýzy elektrodu opatrně vytáhněte z roztoku, osušte fénem a pečlivým vážením určete novou hmotnost katody \(m_\mathrm{K2}\). Je třeba dávat pozor, abyste nesetřeli vyloučený kov.
- 6) Z naměřených hodnot vypočítejte Avogadrovu konstantu. Vypočítejte relativní odchylku od správné hodnoty.
Otázky:
- Popište chemické děje probíhající na katodě a anodě.
- Vysvětlete, proč je přírůstek hmotnosti katody stejně velký jako úbytek hmotnosti anody.
- Odhadněte nejistotu měření proudu, času a hmotnosti a pomocí pravidel vysvětlených v kapitole 2 určete absolutní a relativní nejistotu měření Avogadrovy konstanty. Leží tabulková hodnota v intervalu vymezeném touto nejistotou? Pokud ne, vysvětlete, co může být příčinou.
K přípravě roztoku pro elektrolýzu se doporučuje rozpustit 100 g modré skalice (CuSO4 ⋅ 5 H2O) v 1 litru vody, což by odpovídalo molární koncentraci 0,4 mol/l. Do roztoku se doporučuje přidat také 10 ml koncentrované H2SO4, čímž se sníží pH, a nedochází ke srážení hydroxidu měďnatého; ovšem elektrolýza bude fungovat i bez přítomnosti kyseliny.
Jelikož přírůstek hmotnosti katody je v tomto experimentu přibližně 0,7 g, je nutné vážit na váze s citlivostí minimálně 0,01 g. Máte-li k dispozici odpovídající digitální váhu, tato část experimentu se výrazně urychlí. V tomto případě doporučujeme zvážit i anodu a určovat Avogadrovu konstantu také z úbytku její hmotnosti.

