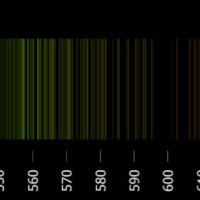
Vznik spekter
V předchozí kapitole jsme si ukázali, že světlo můžeme rozložit na barvy pomocí optického hranolu. Spektrum můžeme získat také tím, že se světlo odrazí na mřížce nebo jí projde.

Zdroj
Optický hranol i optická mřížka jsou základem přístrojů zvaných spektroskop. Rozlišujeme tedy dva druhy spektroskopů: hranolový a mřížkový. V prvním z nich využíváme disperze světla na optickém hranolu, ve druhém difrakce světla na mřížce (viz kapitola 24.).
Současné spektrometry (na rozdíl od spektroskopu spektrometrem můžeme změřit i vlnové délky jednotlivých barev) využívají optické difrakční mřížky na odraz, neboť ty nám umožňují lépe rozlišit jednotlivé vlnové délky. Difrakční mřížka je blok skla pokrytý vrstvou kovu (kupř. Al), na jehož povrchu je rytím, případně jinými technikami, vytvořena soustava jemných čar. Těch bývá několik stovek nebo i tisíc na 1 mm.
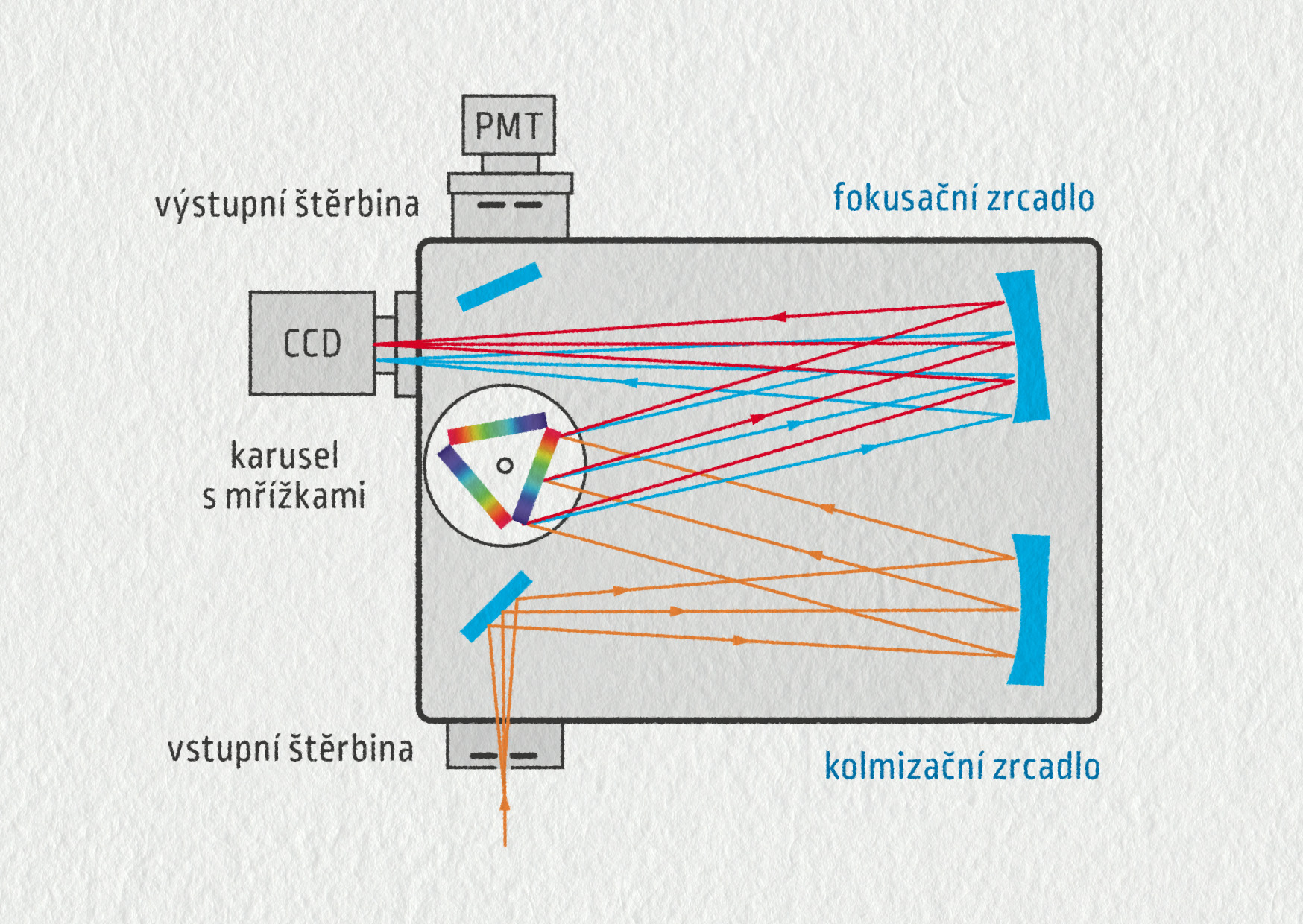
Na obrázku vidíme schéma typického spektrometru s montáží Czerny–Turner. Světlo ze zkoumaného zdroje je přivedeno např. optickým vláknem na vstupní štěrbinu spektrometru a dopadá na kolimační zrcadlo, které z něj vytváří rovnoběžný svazek. Tento svazek je rozdělen podle barvy světla na difrakční mřížce (ve spektrometru mohou být na výběr i tři různé mřížky). Jednotlivé barvy jsou druhým zrcadlem soustředěny na detektor. Kvalita spektrometru je do značné míry určena použitým detektorem. V případě plošného detektoru (CCD nebo CMOS) se obraz štěrbiny promítne v různých barvách do různých míst detektoru, pak pozorujeme spektrální čáry současně na určitém intervalu vlnových délek. V případě jednoduchého detektoru, jako je fotonásobič (PMT), je obraz zaostřen na výstupní štěrbinu zařazenou před detektorem. Ta propustí jen velmi úzkou část spektra. Spektrum se pak získá skenováním, tj. postupným otáčením mřížky a měřením signálu na nastavené vlnové délce.
Zdroj
Rozdělení spekter
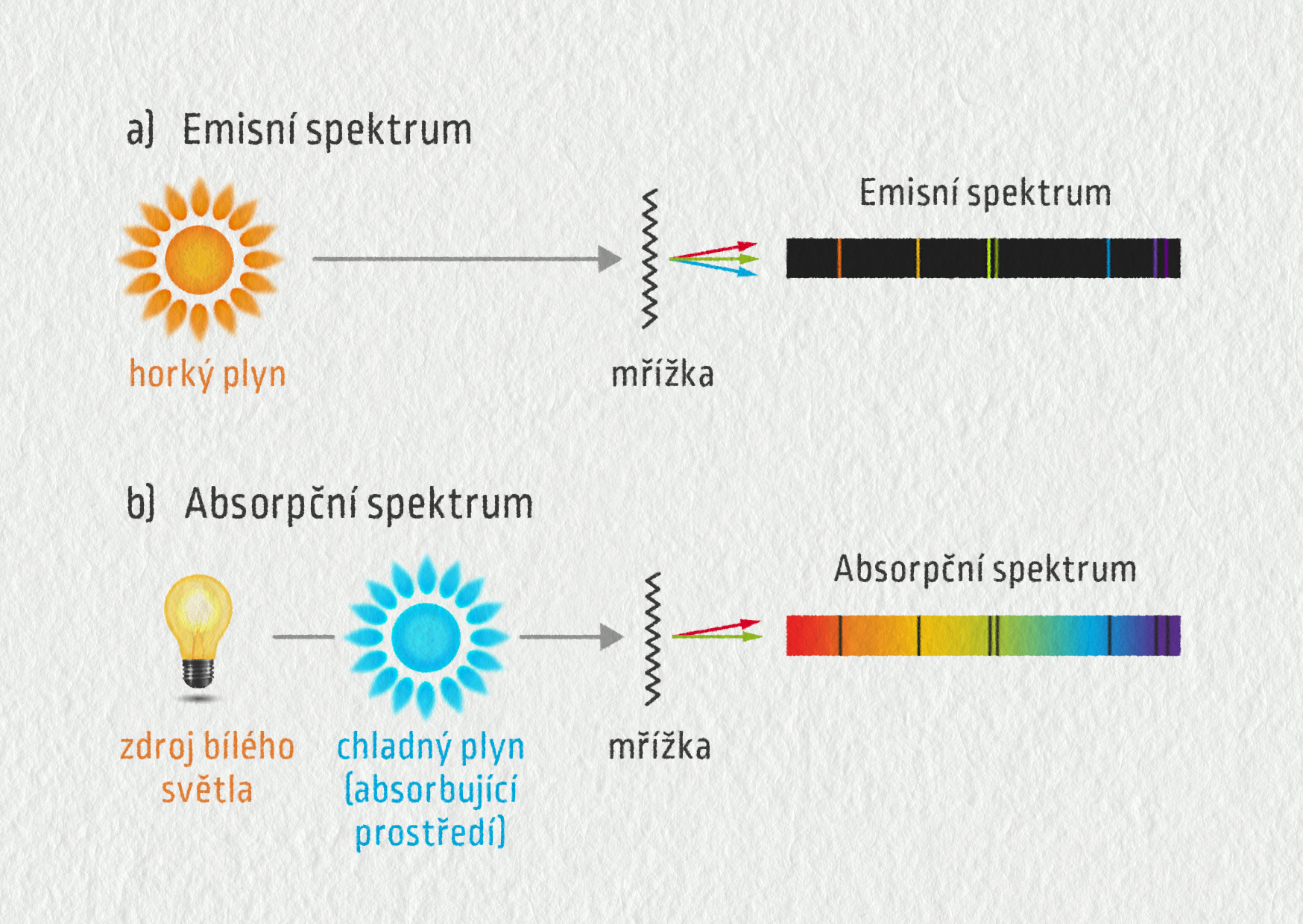
Podle toho, jak spektrum vzniklo, rozlišujeme spektrum emisní a spektrum absorpční.
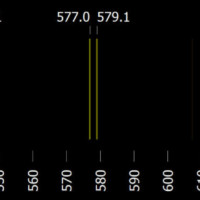
Emisní spektrum pozorujeme v případě, kdy je v látce dost energie na to, aby atomy látky byly excitovány. Tuto energii látka může získat různými způsoby, např. zahřátím (sodík v plameni), osvícením (luminofor zářivky nebo bílé ledky) nebo srážkami s jinými částicemi (s elektrony elektrického výboje).
Ze světla vysílaného samotnou látkou vymezíme úzký svazek, který soustředíme čočkou nebo zrcadlem na optický hranol či mřížku. Po odrazu světla na mřížce můžeme na stínítku, v dalekohledu nebo na elektronickém čipu pozorovat emisní spektrum světelného zdroje.
Zdroj
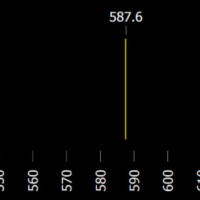
U látky, která sama nemá dost energie na to, aby svítila, můžeme stále ještě pozorovat absorpční spektrum. Vezmeme zdroj bílého světla, jehož spektrum je spojité. Takovým zdrojem je například žárovka.

Zdroj
Toto světlo necháme zkoumaným vzorkem látky, například chladný plyn uzavřený v trubici, případně roztok uvedené látky. Některé vlnové délky budou látkou pohlceny, a na spojitém pozadí se tak objeví černé absorpční čáry.

Zdroj
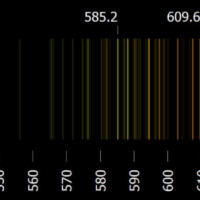
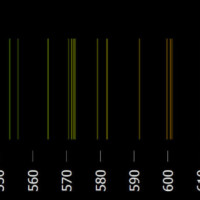
Tyto čáry odpovídají barevným čarám, které u daného prvku najdeme v emisním spektru. Obě spektra, emisní i absorpční, jsou velmi podobná. Barvy, které chybí v absorpčním spektru, nalezneme v emisním spektru (emisní spektrum ovšem bývá na počet čar bohatší). Společně tak mohou sloužit k precizní analýze zkoumaných látek. Jak vypadá emisní a absorpční spektrum různých prvků, se můžete podívat na této simulaci.
Vznik světla
Pojetí vzniku, nebo naopak pohlcování světla v atomu není v souladu s klasickou fyzikou. K pochopení toho, jak v atomu vzniká světlo, velmi významně přispěl dánský fyzik Niels Bohr. V roce 1913 publikoval sérii článků a v prvním z nich použil Planckovu myšlenku kvantování energie, aby objasnil vznik atomových spekter.
Zásadní jsou tyto dvě myšlenky:
Podmínky kvantování energie atomu:
1. Energie atomu může nabývat pouze určitých hodnot.
2. Atom může buď vyzařovat, nebo pohlcovat energii pouze při přechodu elektronu z jednoho energetického stavu do druhého. Energie odpovídající tomuto přechodu je rovna rozdílu energií jednotlivých hladin označených indexy \(n\) a \(m\):
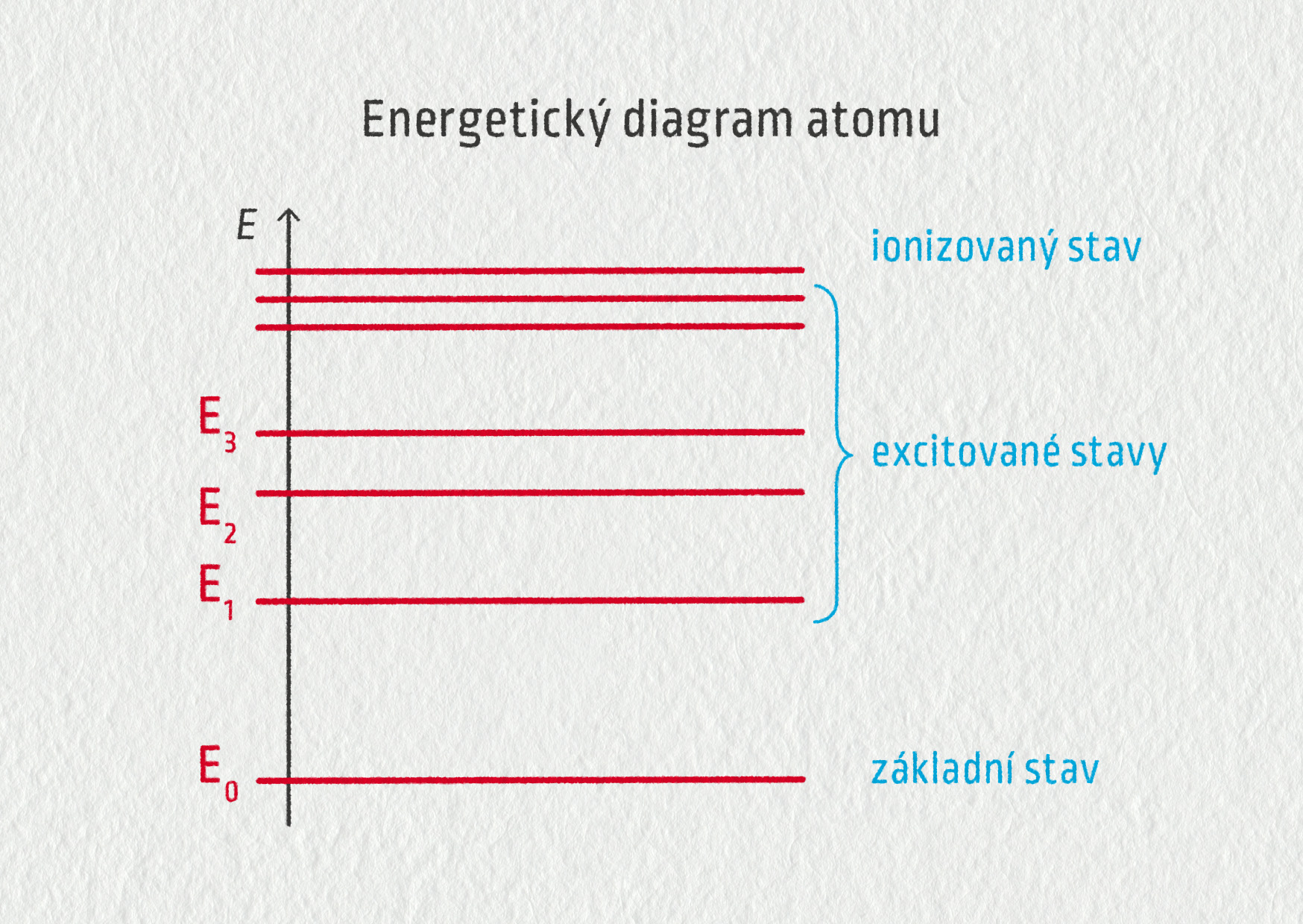
\[ E = E_n - E_m \]První podmínka říká, že energie atomu je kvantována. To znamená, že energie atomu nabývá pouze určitých diskrétních hodnot, což zakreslujeme do energetického diagramu. V tomto diagramu máme pouze jednu svislou osu, na kterou vynášíme hodnoty energií atomu v elektronvoltech (eV). Její hladiny znázorňujeme vodorovnými úsečkami. Čím je energie atomu vyšší, tím výše je tato úsečka v diagramu umístěna.
Zdroj
Jestliže je energie atomu minimální, hovoříme o základním stavu atomu. Ve spektroskopii mu obvykle přiřadíme hodnotu energie \(E_0=0\ \mathrm{eV}\). Tomuto stavu odpovídá takové uspořádání elektronů v elektronovém obalu, kdy jsou elektrony na nejnižších dovolených hladinách. Tento stav atomu je stabilní.
Vyšší hladiny v energetickém diagramu označujeme jako excitované stavy atomu. Těchto stavů je velmi mnoho, každý z nich odpovídá určité elektronové konfiguraci, ve které je alespoň jeden nebo více elektronů ve vyšších hladinách. Tyto stavy nejsou stabilní, atom v nich zůstává pouze po krátkou dobu (od 1 do 10 ns). Poté se vrací do základního stavu. Tomuto návratu říkáme deexcitace.
Aby se elektron dostal na místo odpovídající celkové vyšší energii atomu, musí přijmout tuto energii například ve výboji, při srážce s elektronem nebo, jak si ukážeme dále, od vhodného dopadajícího fotonu.
To, jak jsou v elektronovém obalu rozmístěny energetické hladiny a elektrony, je snadné si představit pro atom vodíku, ve kterém kolem kladně nabitého protonu obíhá pouze jediný elektron. Taková byla Bohrova, dnes již překonaná, představa uspořádání atomu vodíku. Jakmile ale máme v elektronovém obalu více elektronů, možných „poloh“ elektronu vzhledem k jádru a vzhledem k ostatním elektronům je velmi mnoho a každé takové konfiguraci odpovídá určitá hladina v energetickém diagramu atomu.
Vznik světla souvisí právě s elektronovými přechody a změnou energetického stavu atomu. Jestliže se atom nachází v některém z excitovaných stavů, elektron přejde na nižší hladinu a přebytečná energie musí být z atomu odnesena (obrázek 25.22a). Jestliže atomu naopak dodáme energii, která odpovídá rozdílu mezi dvěma energetickými hladinami, záření je atomem pohlceno a dochází k elektronovému přechodu na vyšší hladinu (obrázek 25.22b). Tyto přechody popisuje druhá podmínka kvantování. Energie vyzářeného nebo pohlceného fotonu má tedy hodnotu \(E=E_n-E_m=hf\).

Zdroj
Protože energetické hladiny jsou kvantovány, elektronové přechody jsou kvantovány rovněž. Jim odpovídající energie nabývá pouze určitých hodnot, a proto nemůže být atomem pohlcen nebo vyzářen foton o libovolné frekvenci, ale pouze ten, jehož energie odpovídá přechodu mezi dvěma energetickými hladinami. To je důvod, proč jsou spektra atomů čárová.
Jestliže zde hovoříme o atomových spektrech a jejich čarovém charakteru, máme na mysli volný atom, nikoliv atom v molekule nebo v pevné látce. V případě molekul bychom do celkové energie museli započítat i rotační a vibrační energii, což poměrně komplikuje náš teoretický model.
Hypotetický atom a absorpce záření
Uvažujme zcela smyšlený modelový atom s energiemi 0 eV (základní stav), 4 eV, 6 eV a 7 eV (excitované stavy). Jaké jsou energie fotonů, které může atom absorbovat?
Nejprve si nakresleme energetický diagram tohoto atomu.
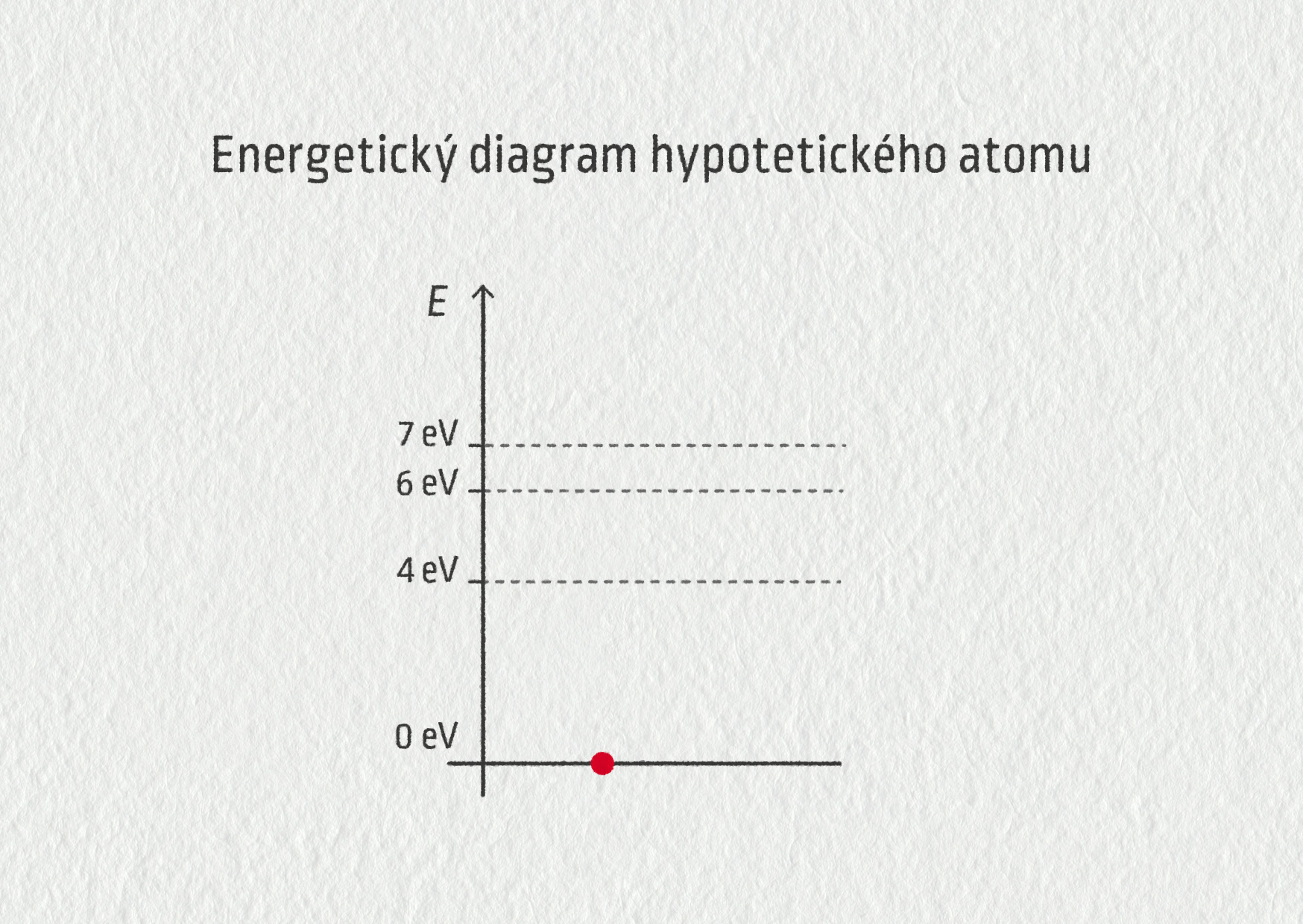
Zdroj
Při elektronovém přechodu je foton zcela pohlcen a jeho energie je odevzdána atomu. To znamená, že může být absorbován pouze foton nesoucí energii o velikosti 4 eV, 6 eV nebo 7 eV. Jiné hladiny energie nejsou povoleny.
Hypotetický atom a emise záření
Uvažujme znovu modelový atom s energiemi 0 eV (základní stav), 4 eV, 6 eV a 7 eV (excitované stavy). Jaké energie fotonů může tento atom vysílat, jestliže se nachází ve druhém excitovaném stavu o energii 6 eV?
Opět znázorníme červeným puntíkem, že se atom nachází ve stavu s energií 6 eV.
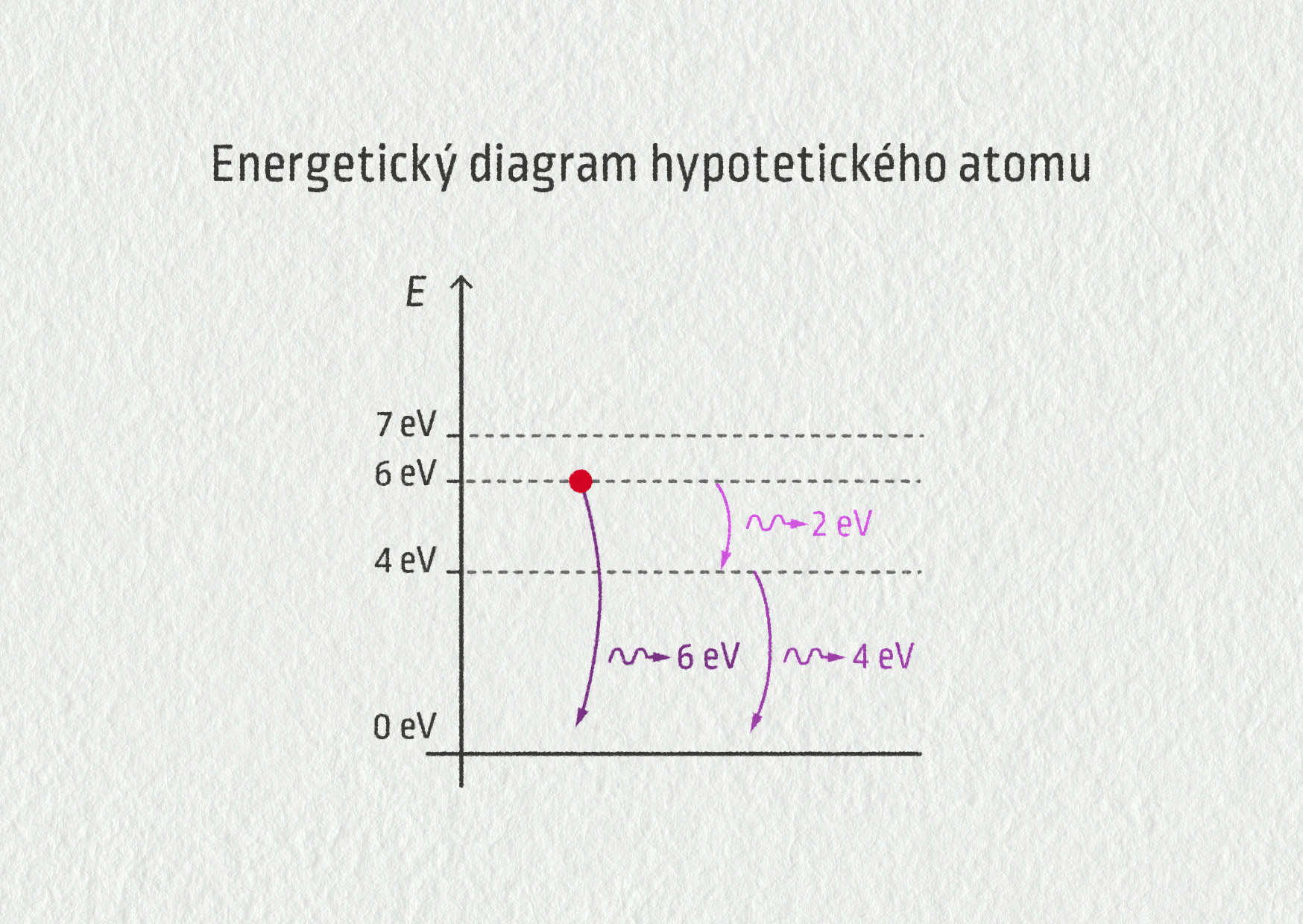
Zdroj
Mohou nastat dvě možnosti. Elektron se vrátí přímo do nejnižšího stavu a vyzáří při tom odpovídající energii o velikosti rozdílu těchto hladin, tj. 6 eV. Druhou možností je, že elektron přeskočí do nižšího excitovaného stavu, zde je to hladina 4 eV, a vyzáří pouze energii o velikosti 2 eV. Teprve poté se vrátí do základního stavu a vyzáří zbývající 4 eV.
Frekvence atomem vysílaného světla
Vypočítejte, jaké frekvence a vlnové délky by odpovídaly elektronovým přechodům z předchozího řešeného příkladu.
Pro energii nesenou fotonem, který vznikne přechodem elektronu mezi dvěma energetickými hladinami atomu, platí: \(E=E_n-E_m=hf\). Odtud pak pro frekvenci světla dostáváme
\[ f = \frac{E_n-E_m}h = \frac{(6\ \mathrm{eV}-0\ \mathrm{eV})\cdot1{,}6\cdot10^{-19}\ \mathrm{J}\cdot\mathrm{eV}^{-1}}{6{,}64\cdot10^{-34}\ \mathrm{J}\cdot\mathrm{s}} = 1{,}5\cdot10^{15}\ \mathrm{Hz}\;. \]Ve vakuu by měl tento foton vlnovou délku
\[ \lambda = \frac cf = \frac{3\cdot10^8\ \mathrm{m/s}}{1{,}5\cdot10^{15}\ \mathrm{Hz}} = 2{,}0\cdot10^{-7}\ \mathrm{m} = 200\ \mathrm{nm}\;, \]což odpovídá ultrafialovému světlu. Přeskoku o energii 4 eV pak přísluší frekvence 9,7 ⋅ 1014 Hz a vlnová délka o velikosti 310 nm, která opět leží v ultrafialovém oboru. Teprve pro přechod odpovídající energii 2 eV získáme frekvenci 4,8 ⋅ 1014 Hz a vlnovou délku 620,6 nm, která se nachází ve viditelné oblasti (červená barva).
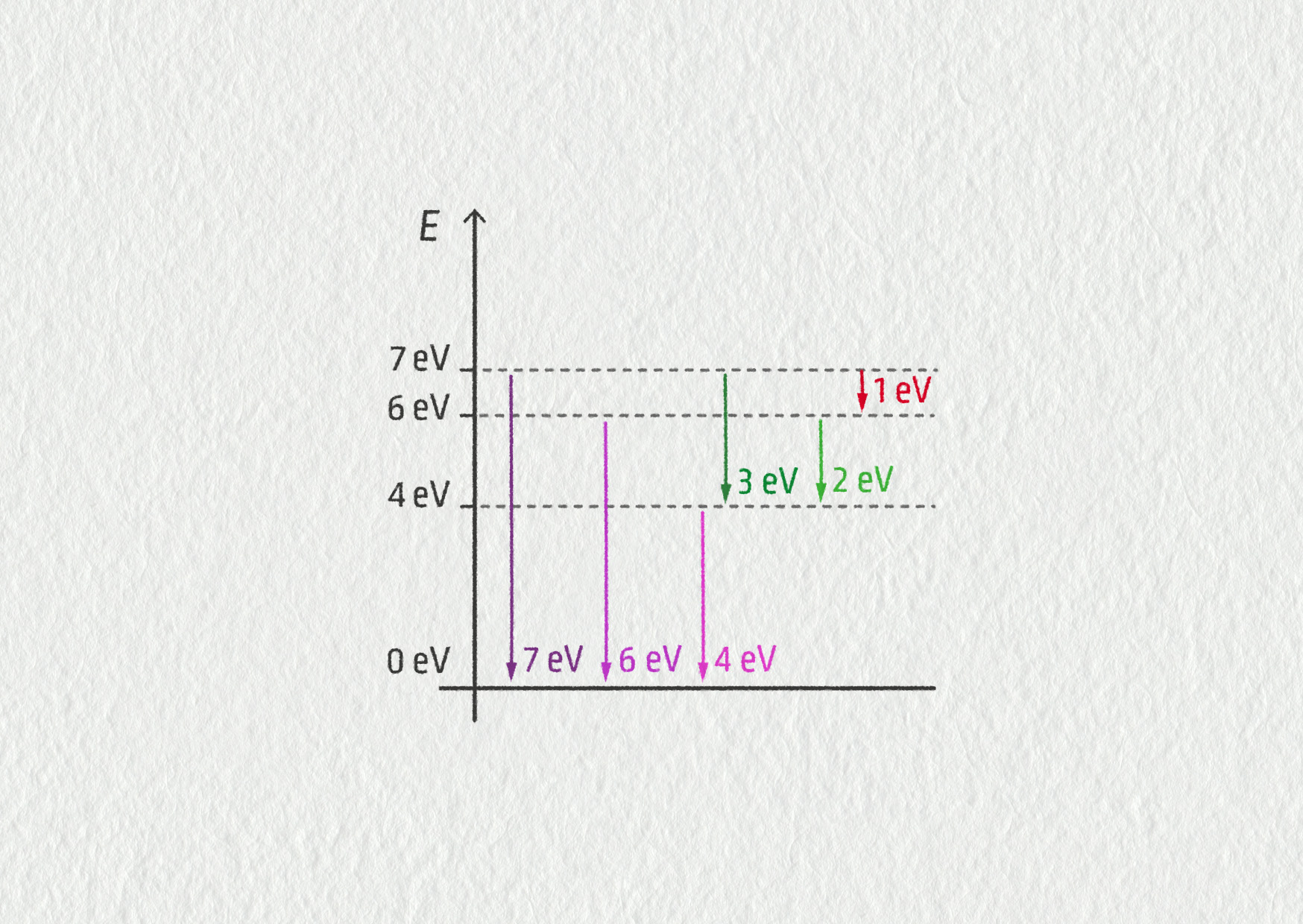
Zdroj
Elektrony v blízkosti atomového jádra jsou u něj poměrně dobře drženy. Přechody elektronů tak nastávají převážně u elektronů z vyšších energetických hladin (valenčních vrstev). Pokud elektronu dodáme energii rovnou nebo vyšší, než by odpovídalo rozdílu mezi maximální možnou energií daného atomu a jeho aktuální energií, elektron bude zcela vytržen z elektronového obalu a přebytečnou energii odnese ve formě své kinetické energie. Dojde k ionizaci atomu, z neutrálního atomu se stane kladný iont. V takovém případě hovoříme o ionizovaném stavu atomu.
V reálném atomu je situace obvykle složitější. Přechody mezi různými stavy atomu jsou různě pravděpodobné. Tato pravděpodobnost je pak jedním z faktorů ovlivňujících intenzitu spektrální čáry. Mezi některými stavy jsou přechody doprovázené emisí fotonu dokonce zakázány. Jim odpovídající čáry ve spektru obvykle nenajdeme, případně jsou velice slabé. Více v následující galerii atomových spekter.