Co se děje uvnitř zdroje?
Jak zdroj vytváří napětí? Co se děje uvnitř zdroje, že je jeho jeden pól kladný a druhý záporný? Jakým mechanismem se přečerpávají elektrony uvnitř zdroje? Zkusme najít odpověď na tyto netriviální otázky.
Základní rozdělení
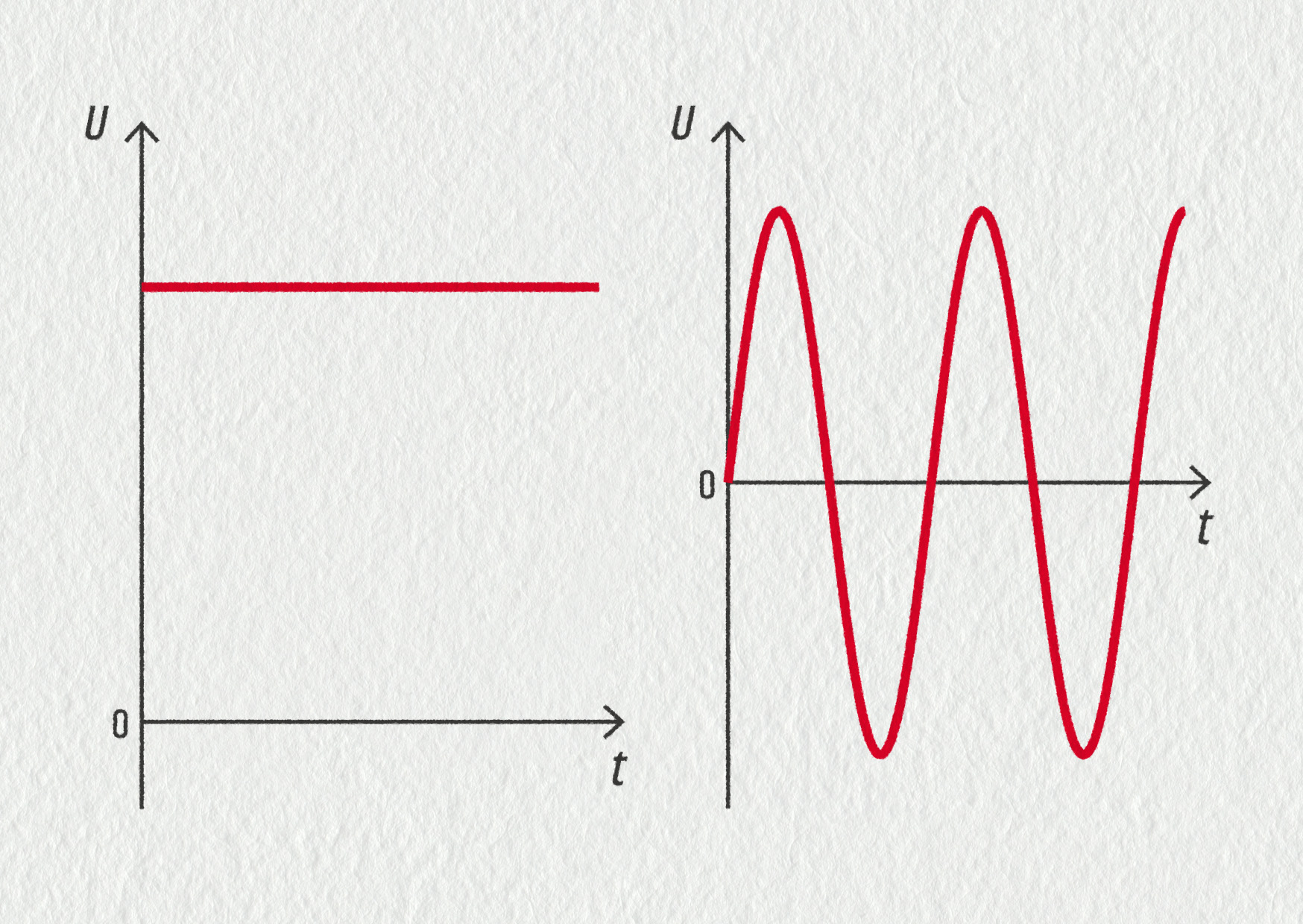
Elektrické zdroje rozdělujeme na stejnosměrné a střídavé.
Stejnosměrné zdroje mají jednu svorku trvale kladnou (kladný pól, nedostatek elektronů) a druhou trvale zápornou (přebytek elektronů). Napětí mezi svorkami nemění polaritu. Po zapojení stejnosměrného zdroje se v obvodu objeví stejnosměrný proud – teče stále stejným směrem.
Polarita svorek střídavého zdroje se mění – po určitou dobu je + na jedné svorce, pak se situace obrátí. Takový zdroj vytváří proměnlivé napětí, jehož znaménko se střídavě mění. Po zapojení tohoto zdroje do obvodu se v něm objeví střídavý proud – teče chvíli tam, chvíli zpět.
Zdroj
Zdroje lze také dělit podle mechanismu, jakým vytvářejí napětí.
Elektrochemické zdroje – typicky články a akumulátory – k tomu využívají energii chemických látek. Vytvářejí vždy stejnosměrné napětí. Budeme se jimi zabývat v následujících odstavcích této podkapitoly.
Zdroje elektromagnetické – například dynamo a alternátor – jsou založeny na jevu zvaném elektromagnetická indukce, prozkoumáme je v rámci 20. kapitoly. Dynamo vyrábí stejnosměrné a alternátor střídavé napětí.
V posledních deseti letech do popředí vystupují zdroje fotovoltaické – typicky fotovoltaické panely solární elektrárny, ale i miniaturní článek na kalkulačce –, které vytvářejí stejnosměrné napětí díky vnitřnímu fotoelektrickému jevu. Dočtete se o nich více v 25. kapitole.
Pro úplnost dodejme, že napětí vzniká i pouhou nerovnováhou teplot – termoelektrický jev se využívá k měření teploty v termočláncích, a naopak ke chlazení v tzv. Peltierových článcích.
Vodivostní elektrony uvnitř kovu se v jistém ohledu chovají jako plyn. Pohybují se chaoticky, každý jinou rychlostí a jiným směrem, srážejí se. Představte si nyní dlouhý tenký vodič, který na jedné straně zahřejeme. Zvýšením teploty se na tomto konci začnou elektrony v průměru pohybovat rychleji, budou se s ostatními srážet prudčeji, a vytvářet tak vyšší tlak. Jenže plyn, jak známo, proudí z místa s vyšším tlakem do místa o tlaku nižším, takže některé elektrony ze zahřátého konce se přesunou do konce chladnějšího. Tím pádem se ovšem chladnější konec začne nabíjet záporně a teplejší konec kladně… a máme zdroj napětí! Nutno podotknout, že tento proces se velice brzy zastaví (nastane rovnováha), neboť přesunuté elektrony se vzájemně odpuzují, a jsou vzniklým elektrickým polem taženy zpět k teplejšímu konci. Proto je vzniklé napětí malé, řádově 10 µV na jeden °C. Pro nepříliš velký teplotní rozdíl \(\Delta t\) můžeme termoelektrické napětí zapsat vztahem \(U = \alpha\cdot\Delta t\), kde \(\alpha\approx10^{-5}\ \mathrm{V/^\circ C}\) je tzv. Seebeckova konstanta.
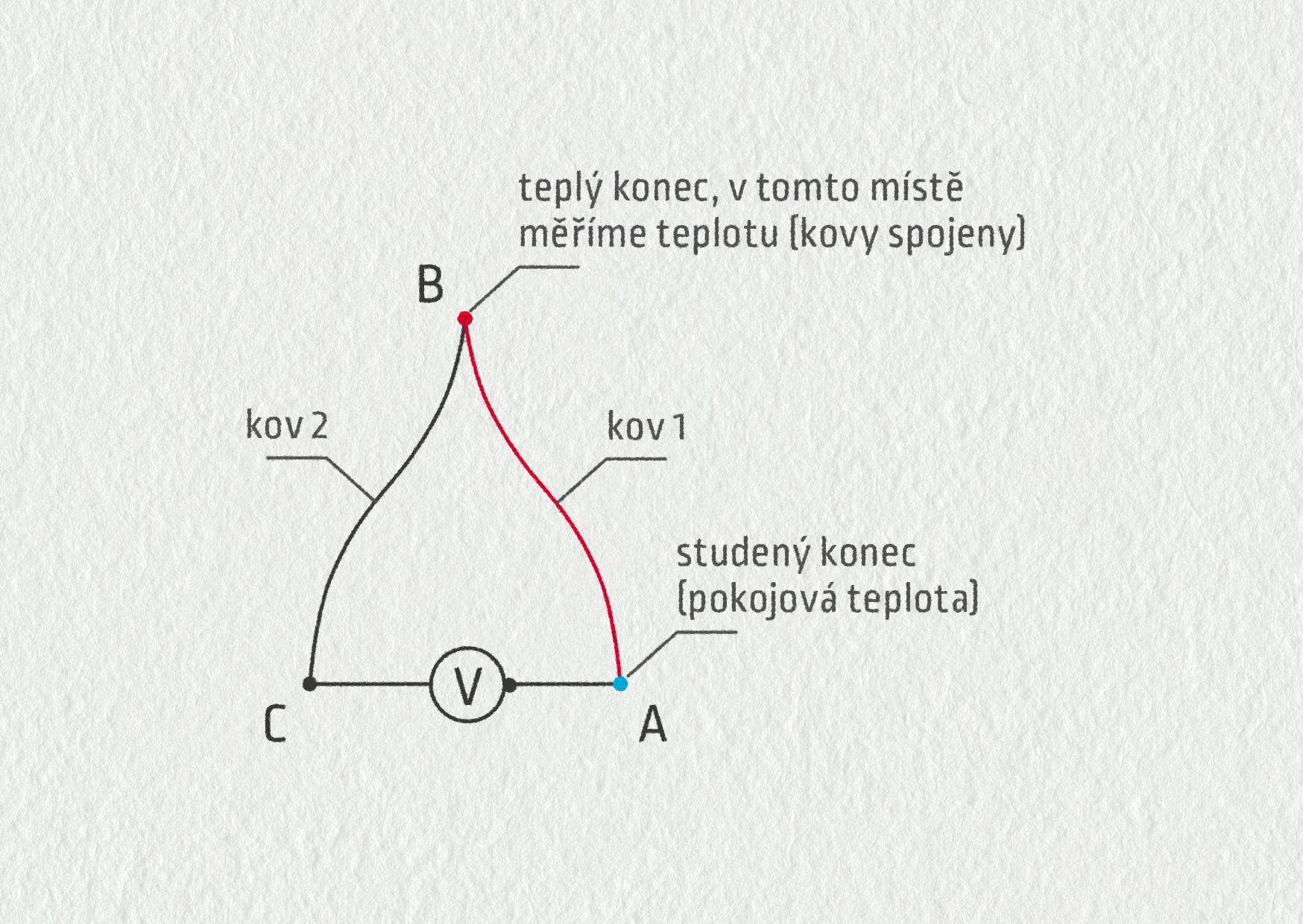
Termočlánek se používá k měření teploty. Vznikne spojením dvou kovů, které mají rozdílnou Seebeckovu konstantu: na každém kovu vzniká jiné termoelektrické napětí (\(U_{BA}\) a \(U_{BC}\)), voltmetrem měříme rozdíl těchto napětí \(U_{AC}\) a dopočítáváme rozdíl teplot \(\Delta t = U_{AC}/(\alpha_2-\alpha_1\))
Zdroj

Zdroj
Galvanické články
Fungování elektrochemických zdrojů, nazývaných též galvanické články, využívá zdokonalený princip historicky prvního článku, který sestavil Alessandro Volta v roce 1800. K vytvoření článku totiž stačí dva různé kovy a elektrolyt (= kapalina obsahující ionty). Volta použil měď, zinek a zředěný roztok kyseliny sírové.
Ponoříme-li kovový plíšek (neutrální) do kapaliny obsahující ionty, budou buďto atomy kovu vstupovat v podobě iontů do kapaliny, anebo ionty z kapaliny se budou zachytávat na kovovém plíšku. Která z možností nastane, závisí na energii vodivostních elektronů v krystalové mřížce kovu.
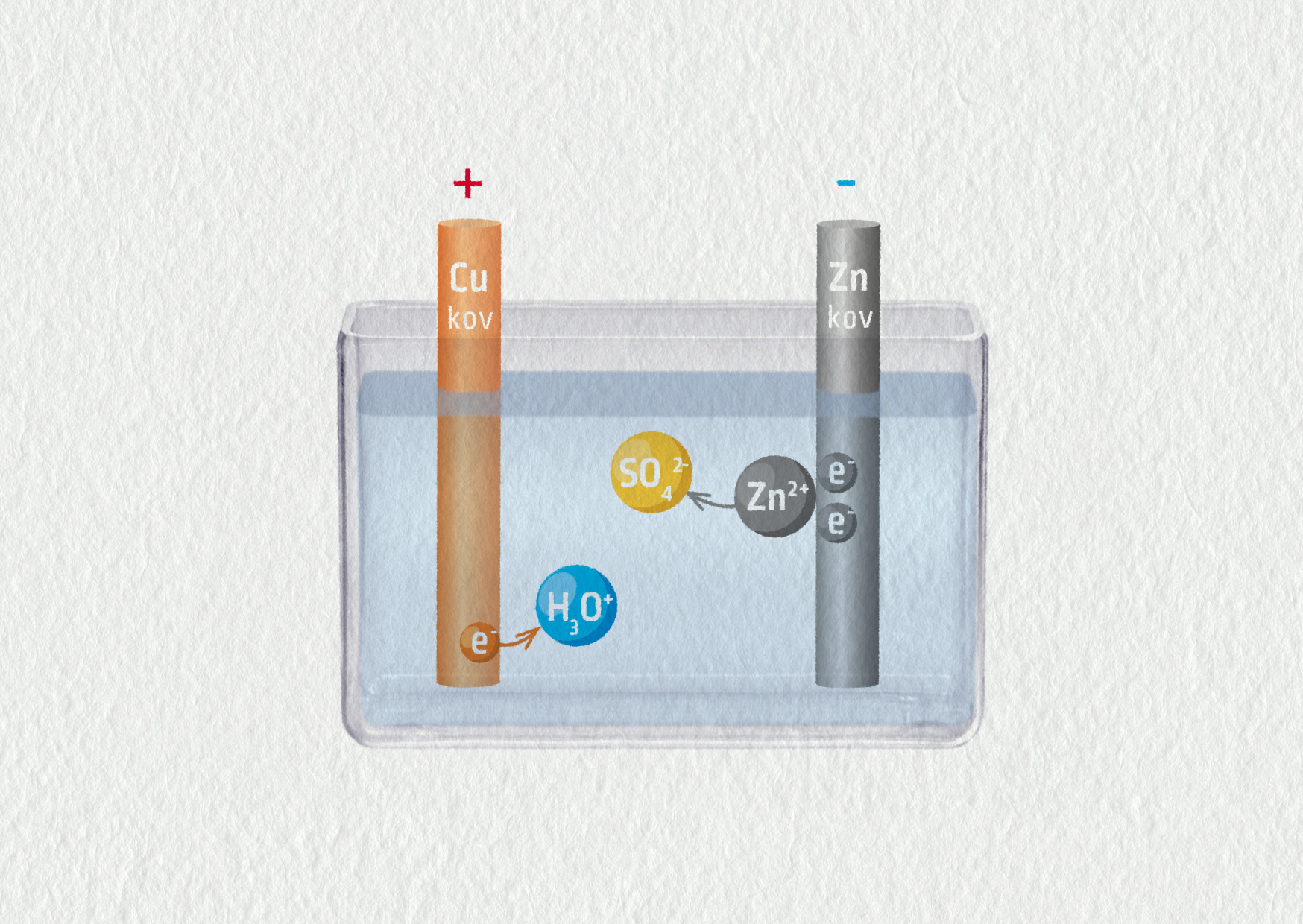
Například u neutrálního zinku je energie elektronů nízká, a elektrony mají tendenci zůstávat v kovu (asi tak jako má kulička tendenci zůstat v jamce). Atom zinku se může z okraje mřížky uvolnit, zanechá ovšem v kovu 2 elektrony a vstupuje do kapaliny jako iont Zn2+. Plíšek se rozpouští a nabíjí se záporně.
Naopak v mědi je energie elektronů vysoká, a elektrony mají tendenci odcházet do kapaliny (asi tak jako má kulička tendenci kutálet se do jamky). Jakmile se k měděnému plíšku přiblíží kladný iont, zachytí elektrony z plíšku a jako neutrální atom ulpí na povrchu kovu. Ionty z roztoku se zachycují na kovu, ten se nabíjí kladně.
Správně tušíte, že Zn tvoří záporný pól a Cu kladný pól prvního článku na světě. Vzniklé napětí má hodnotu 1,1 V.
Zdroj
Důležitou roli hraje i elektrolyt a pro každý článek vypadají reakce na elektrodách jinak. V případě Voltova článku je elektrolytem kyselina sírová. Vysvětleme si jeho princip ještě jednou a pečlivěji.
Molekuly H2SO4 ve vodě samovolně disociují na 2H+ a SO42−. Protony H+ jsou v kapalině nestabilní a okamžitě reagují s vodou H+ + H2O → H3O+. Čili elektrolyt je tvořen především ionty síranovými SO42− a ionty oxoniovými H3O+.
Nyní vložíme elektrody. Zinek se rozpouští do roztoku Zn → Zn2+ + 2e−. Ionty Zn2+ reagují se síranovými za vzniku neutrálního síranu zinečnatého, který pokrývá zinkovou elektrodu Zn2+ + SO42− → ZnSO4. Měděná elektroda odevzdává iontům H3O+ elektrony a vzniká voda a molekuly vodíku H2, které jakožto plyn vybublávají z elektrolytu: 2H3O+ + 2e- → 2H2O + H2. Zinková elektroda se nabila záporně, měděná elektroda kladně. Tyto reakce se samovolně zastaví v rovnováze – v okamžiku, kdy bude energie elektronů v nabitých elektrodách stejná jako energie iontů v kapalině.
Zapojíme náš článek do obvodu. Elektrony ze zinkové elektrody budou proudit vnějším obvodem přes spotřebiče na měděnou elektrodu, elektrody se budou vybíjet a předchozí reakce se obnoví. Zinek se čím dál víc pokrývá vrstvičkou zinečnaté soli, u měděné elektrody vybublává vodík. Tyto procesy jsou nevratné, článek se postupně znehodnocuje. Fungování se zastaví zcela, když se z elektrolytu spotřebují všechny ionty SO42-, nebo když se celá Zn elektroda obalí síranem, který tuto elektrodu odizoluje od elektrolytu.
Alessandro Volta

Zdroj

Zdroj

Zdroj
Která kombinace kovů bude vytvářet největší napětí?
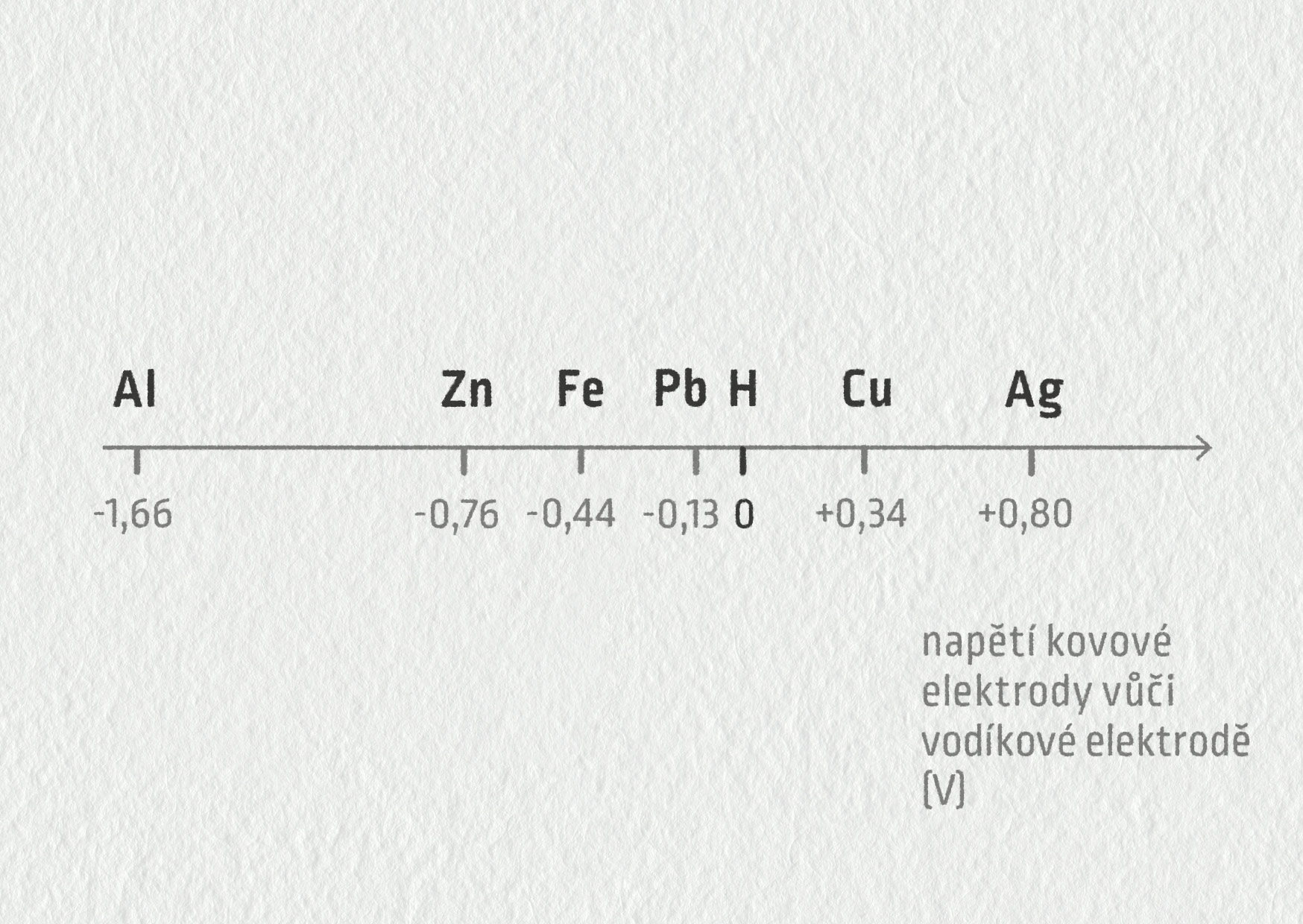
Zajisté uhodnete, co se stane, když do elektrolytu ponoříme dva stejné kovy – ano, oba se nabijí stejně, takže napětí mezi nimi bude nulové. Musíme tudíž vzít dva různé kovy. Následující schéma 8.11 ukazuje, jakým napětím se nabíjí kov ponořený do roztoku svých iontů vůči vodíkové elektrodě (což je ve skutečnosti platinová elektroda, na které se redukují vodíkové ionty na plynný vodík).
Zdroj
Například na článku tvořeném stříbrem a mědí vzniká napětí 0,80 V − 0,34 V = 0,46 V, přičemž Ag je kladný pól. Na článku tvořeném mědí a zinkem je napětí 0,34 − (−0,76) = 1,10 V, přičemž Cu je kladný pól.
Pokud s elektrodou reagují jiné ionty než ionty daného kovu, jsou hodnoty napětí jiné. Podrobně se touto problematikou zabývá elektrochemie.
Používané baterie

Zdroj
S bateriemi se setkáte na každém kroku – od miniaturních jednorázových knoflíkových v kalkulačce a teploměru přes nabíjecí baterie do mobilních telefonů až po akumulátorové baterie v autech a lodích. Na kvalitě baterií závisí, jestli v příštích letech skutečně lidstvo upustí od spalovacích motorů a přejde na elektromobily. Každopádně bude užitečné, když si v bateriích uděláme přehled a ukážeme výhody nejběžnějších typů.
Základem každé baterie je galvanický článek.
V jednorázových bateriích jsou chemické děje nevratné, jakmile se vyčerpá energie chemických látek, tento primární článek nelze znovu nabít. Jde zpravidla o knoflíkové, ale též jednorázové tužkové baterie. Dříve používaný článek zinko-uhlíkový (tzv. suchý článek, nejlevnější baterie) je dnes kvůli své malé kapacitě na ústupu. Nahrazují jej články alkalické a zejména články lithiové, které mají podstatně větší životnost a též velmi dobré parametry v mrazivém a horkém prostředí. Tomu odpovídá jejich vyšší cena.
Nabíjecí baterie jsou koncipovány tak, aby chemické děje na elektrodách byly vratné. Odborně se těmto sekundárním článkům říká akumulátory. Nejběžnějším typem byly donedávna akumulátory nikl-kadmiové, nikl-metal hydridové (nabíjecí tužkové baterie, např. do fotoaparátu) a olověné (autobaterie). V dnešní době jsou nejpoužívanější akumulátory lithioiontové (máte je v mobilním telefonu, v notebooku, montují se do elektromobilů) – oproti předchozím typům mají vyšší životnost a velkou kapacitu (při stejné velikosti pojmou přibližně pětkrát více energie).
Každý článek, ať primární či sekundární, vytváří napětí řádově desetiny až jednotky voltu. Vyššího napětí dosáhneme jejich zapojením do série. Vzniká tak baterie článků („baterie“ v užším slova smyslu) – plochá baterie 4,5 V je tvořena třemi jedenapůlvoltovými články, autobaterie 12 V je tvořena šesti články atd.
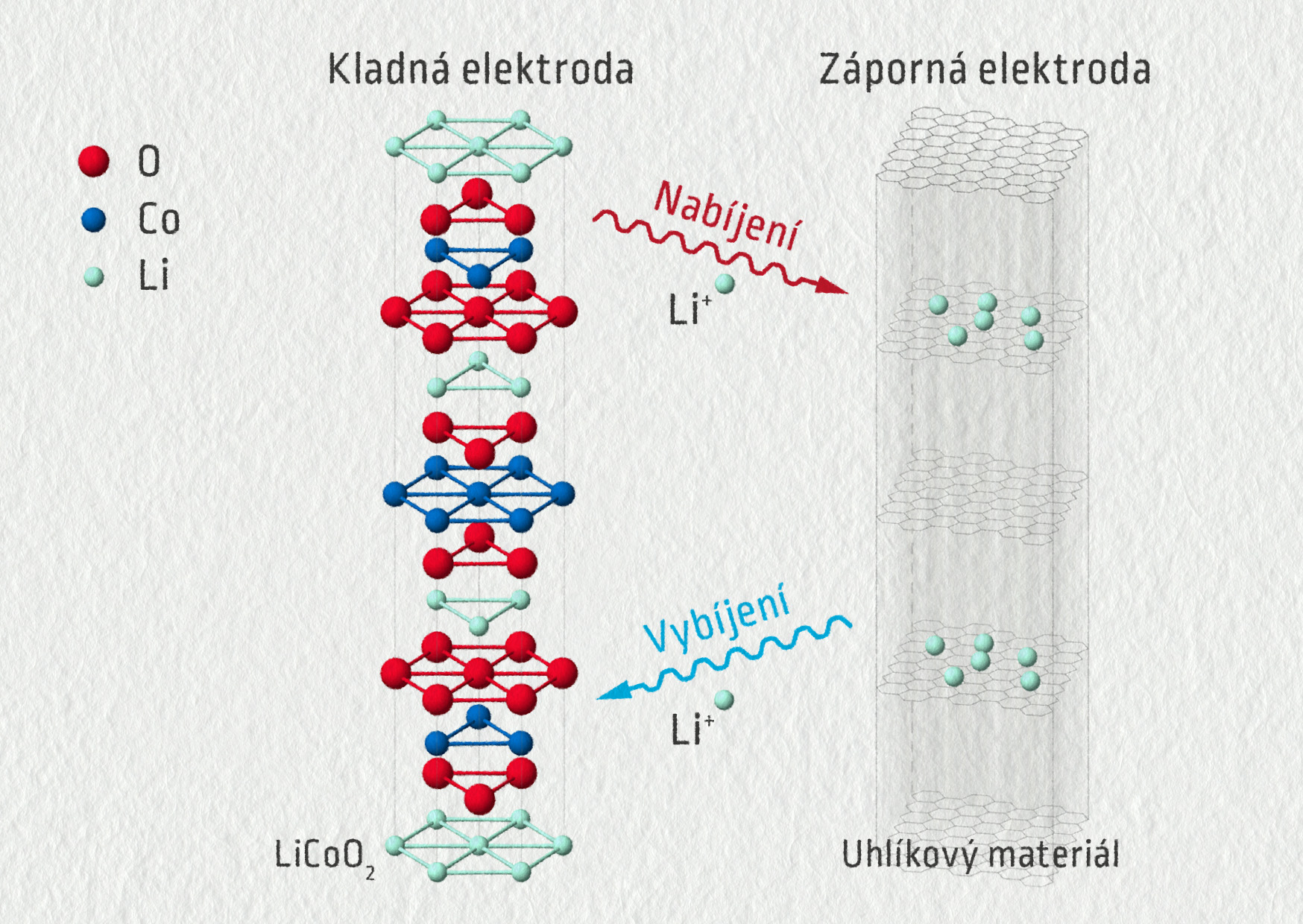
Kladná elektroda je vyrobena z oxidu lithio-kobaltitého, záporná elektroda je tvořena lithiem vázaným v grafitu. Elektrolytem je nejčastěji hexafluorofosfát lithný rozpuštěný v organickém rozpouštědle. Během nabíjení se ionty Li+ přesouvají do krystalové mřížky grafitu, aniž by přímo reagovaly s uhlíkem. Tím se dosahuje výrazně vyšší životnosti oproti NiMH akumulátorům.
Lithium-iontový akumulátor vytváří napětí kolem 3,6 V.
Zdroj

Zdroj
Parametry charakterizující zdroje
Až si budete v obchodě vybírat baterii, zajímat vás bude především typ a napětí, ale také kapacita, životnost, míra samovybíjení a v neposlední řadě zátěž na životní prostředí při její výrobě a likvidaci.
Kapacita zdroje (článku, akumulátoru) je náboj \(Q = It\), který dokáže zdroj přečerpat během jednoho vybití. Jednotkou kapacity zdroje je ampérhodina (Ah), případně miliampérhodina (mAh). Takže například nabitý akumulátor o kapacitě 2,4 Ah by dokázal do obvodu dodávat proud 0,1 A po dobu 24 hodin.
| Zdroj | Kapacita (mAh) | Napětí (V) |
|---|---|---|
| akumulátor Li-ion (iPhone 11ProMax) | 4 000 | 3,7 |
| akumulátor Li-ion (notebook HP) | 5 800 | 14,6 |
| akumulátor Li-ion (sekačka Bosch) | 4 000 | 36 |
| autobaterie olověná (Varta) | 54 000 | 12 |
| alkalická baterie AA (jednorázová) | 1 600 | 1,5 |
| lithiová baterie AA (jednorázová) | 2 900 | 1,5 |
| Ni-MH baterie AA (nabíjecí) | 2 500 | 1,5 |
Z kapacity v Ah lze snadno vypočítat elektrickou energii, kterou může do připojeného obvodu dodat plně nabitý zdroj. Platí \(E=U\cdot It=UQ\) čili stačí kapacitu vynásobit napětím zdroje a získáme energii. Pokud dosadíme kapacitu v Ah, vyjde energie ve watthodinách Wh.
Životnost jednorázové baterie končí jejím vybitím. U běžných Li-ion akumulátorů se životnost pohybuje kolem 1 000 nabíjecích cyklů, poté dochází k jejich postupné degradaci (pokles kapacity).
Nejdůležitější parametr zdroje – napětí – si rozebereme podrobněji. Napětí se odvíjí primárně od konstrukce zdroje – z jakého materiálu jsou elektrody a elektrolyt. Napětí během používání kolísá v závislosti na míře nabití a na odebíraném proudu. Negativně jeho hodnotu ovlivňují také vysoké a zejména nízké teploty.
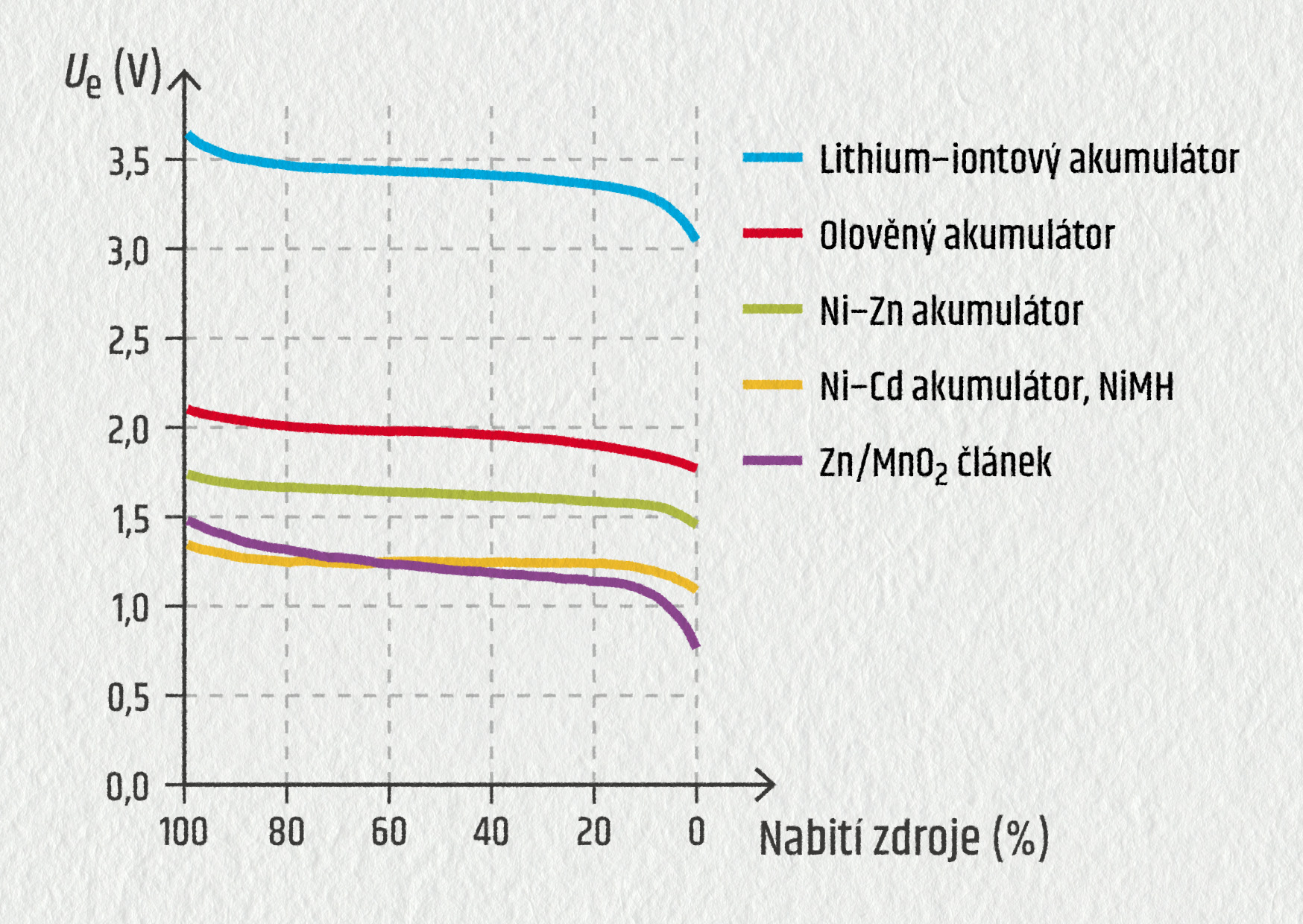
Předpokládejme nejprve, že zdroj není zapojen do obvodu (neodebíráme proud). Napětí mezi póly tohoto nezatíženého zdroje se nazývá elektromotorické napětí Ue. Následující graf ukazuje, že elektromotorické napětí je nižší při menším nabití. Z těchto křivek lze přibližně určit, na kolik procent kapacity je zdroj nabitý. Jak tedy váš mobil pozná, kolik procent kapacity baterie vám zbývá? Prostě změří její napětí.
Zdroj
Vezměme nyní zdroj o jisté hodnotě elektromotorického napětí Ue a zapojme jej do obvodu, ve kterém změnou odporu můžeme regulovat proud tekoucí zdrojem. Voltmetrem měříme napětí na svorkách zdroje, ampérmetrem odebíraný proud – viz schéma 8.17.

Zdroj
Při zkoumání souvislosti mezi napětím a proudem zjišťujeme, že napětí mezi póly zdroje klesá tím víc, čím větší proud zdrojem teče, a že tento pokles je pro nepříliš velké proudy lineární. Tuto skutečnost elegantně vyjádříme rovnicí
\[ U_\mathrm{S} = U_\mathrm{e} - rI, \]kde jsme označili
\(U_\mathrm{S}\) ... svorkové napětí (V) = napětí na svorkách (zatíženého) zdroje,\(U_\mathrm{e}\) ... elektromotorické napětí (V) = napětí nezatíženého zdroje,
\(I\) ... elektrický proud (A),
\(r\) ... vnitřní odpor zdroje (Ω).
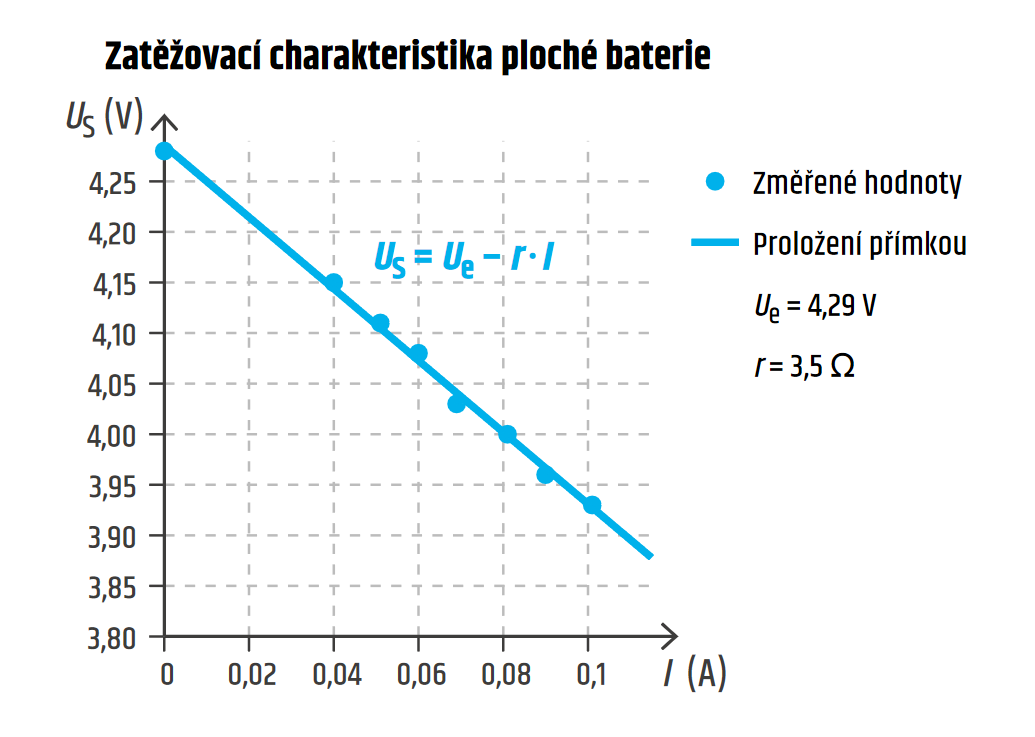
Následující graf ukazuje souvislost mezi \(U_\mathrm{S}\) a \(I\) pro plochou baterii, je to tzv. zatěžovací charakteristika zdroje.
Zdroj
V grafu snadno přečteme elektromotorické napětí \(U_\mathrm{e}=4{,}29\ \mathrm{V}\) (průsečík se svislou osou, \(I=0\ \mathrm{A}\)). Z grafu lze zjistit napětí na zdroji pro libovolnou hodnotu proudu (např. při \(I=0{,}080\ \mathrm{A}\) pokleslo svorkové napětí na \(U_\mathrm{S}=4{,}0\ \mathrm{V}\)). Sklon přímky v grafu je určen vnitřním odporem zdroje \(r\), dosazením do předchozí rovnice lze vypočítat \(r=3{,}54\ \mathrm{\Omega}\).
Obecně platí, že u zdrojů s velkým vnitřním odporem svorkové napětí při zatížení výrazně klesá, jsou to měkké zdroje (např. plochá baterie, fotovoltaický článek, knoflíková baterie do hodinek). Naopak tvrdé zdroje mají malý vnitřní odpor, a tím pádem jejich svorkové napětí se při zatížení mění jen velmi málo (např. Li-ion akumulátor v mobilu). Ideální zdroj by neměl žádný vnitřní odpor a jeho napětí by bylo konstantní (\(U_\mathrm{S}=U_\mathrm{e}\)) bez ohledu na proudový odběr.

Zdroj
Přítomnost vnitřního odporu u reálných zdrojů je příčinou vzniku Jouleova tepla \(Q=rI^2t\) čili jejich zahřívání.
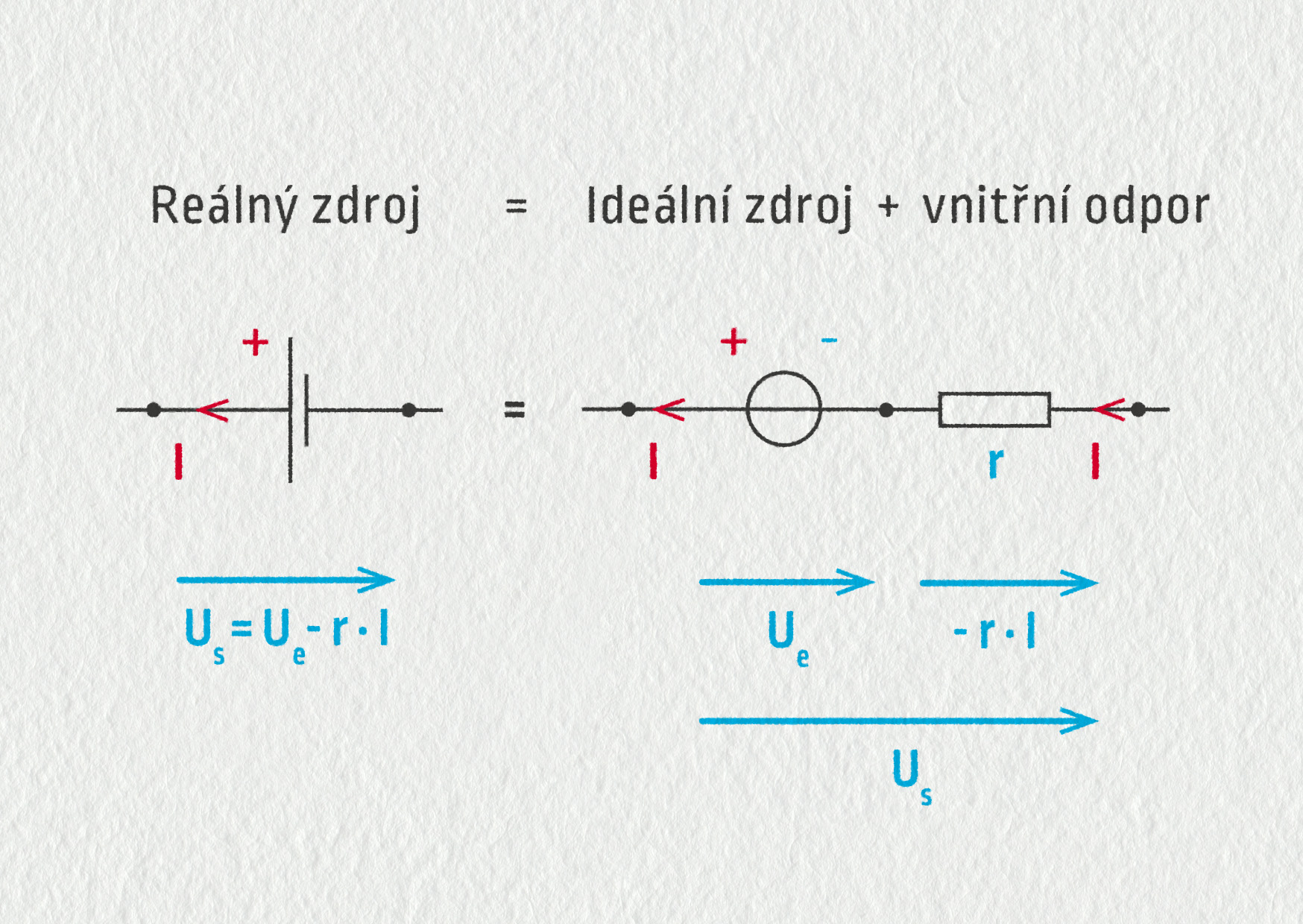
Každý reálný zdroj s vnitřním odporem můžeme ve schématu znázornit ekvivalentně pomocí ideálního zdroje napětí Ue, ke kterému je sériově připojen vnitřní odpor r.
Zdroj

